 Eficácia e segurança
Eficácia e segurança
Clique aqui e leia ao estudo publicado na LANCET
Clique aqui e faça o download do Guia de Radicava® (edaravona)
Conheça os estudos científicos que demonstram a eficácia e segurança de Radicava® (edaravona)

Estudo Clínico Pivotal
No ensaio clínico pivotal de 24 semanas, RADICAVA® demonstrou um declínio significativamente menor na escala ALSFRS-R.1
Função física nas atividades de vida diária na semana 241. Alteração desde a linha e base.

Adaptado de: Writing Group; Edaravone (MCI186) ALS 19 Study Group. Lancet Neurol. 2017;16(7):505-512.
No estudo clínico pivotal, houve alteração 33% menor nas pontuações da ALSFRS-R a partir do valor basal, versus placebo, em 24 semanas. 1
Informações importantes sobre segurança

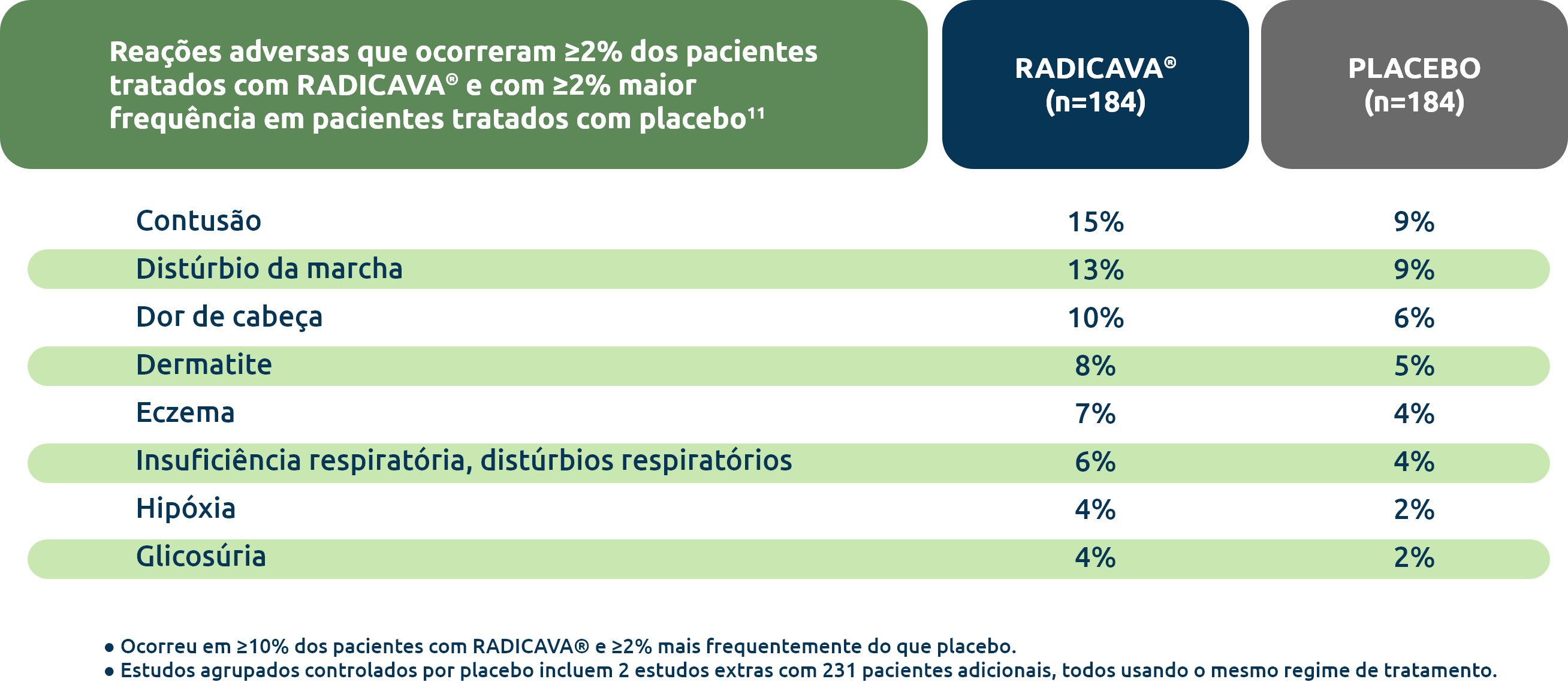
Reações adversas mais comuns3
As reações adversas mais comuns (10% e mais em relação ao placebo) são contusão, distúrbios da marcha e dor de cabeça.

Gestação
O uso de RADICAVA® durante a gravidez não é recomendado. A segurança da edaravona em mulheres grávidas não foi estabelecida.3
A maioria dos pacientes que recebeu RADICAVA® ou Placebo também recebeu Riluzol.9


dos pacientes em uso de RADICAVA® ou Placebo também recebiam Riluzol.9
A segurança foi demonstrada em ensaios agrupados controlados por placebo, nos quais 184 pacientes com ELA receberam RADICAVA® em ciclos de tratamento de 24 semanas.11
A queda na escala funcional (ALSFRS-R) é 33% menor no grupo tratado com RADICAVA® em comparação ao grupo Placebo após 24 semanas.1
Ou seja, evidências clínicas demonstram o benefício do RADICAVA® na diminuição da velocidade de declínio funcional.
A segurança do uso de RADICAVA® em pacientes com ELA* foi avaliada rigorosamente nos estudos clínicos conduzidos para a sua aprovação.
Em um conjunto de análise com 184 pacientes tratados com RADICAVA®, não houve diferenças significativas na incidência de efeitos adversos graves em comparação ao placebo.11
*ELA = esclerose lateral amiotrófica
Referências: 1. Writing Group; Edaravone (MCI-186) ALS 19 Study Group. Safety and efficacy of edaravone in well defined patients with amyotrophic lateral sclerosis: a randomised, double-blind, placebo-controlled trial. Lancet Neurol. 2017 Jul;16(7):505-12. 2. Brooks BR, Berry JD, Ciepielewska M, Liu Y, Zambrano GS, Zhang J, Hagan M. Intravenous edaravone treatment in ALS and survival: An exploratory, retrospective, administrative claims analysis. EClinical Medicine. 2022 Aug 4;52:101590. 3. Bula de Radicava. 4. Brasil. Ministério da Saúde. Medicamentos para o tratamento de Esclerose Lateral Amiotrófica. Brasília, CONITEC, maio de 2023. 5. Agência Nacional de Vigilância Sanitária [Internet]. Disponível em: https://consultas.anvisa.gov.br/#/medicamentos/q/?substancia-8030 [acesso em novembro de 2023]. 6. Protocolo Clínico e Diretriz Terapêutica de ELA (disponível em https://www.gov.br/saude/pt-br/assuntos/protocolos-clinicos-e- diretrizesterapeuticas-pcdt/arquivos/2020/portaria_conjunta_pcdt_ela.pdf, acessado em outubro/23) 7. Neupane P, Thada PK, Singh P, Faisal AR, Rai N, Poudel P, et al. Investigating Edaravone Use for Management of Amyotrophic Lateral Sclerosis (ALS): A Narrative Review. Cureus. 2023;15(1):e33746 8. Conitec. Monitoramento do horizonte tecnológico. Medicamentos para o tratamento de Esclerose Lateral Amiotrófica - Maio 2023. Disponível em: https://www.gov.br/conitec/pt-br/midias/radar/2023/20230526_Informe_MHT_ELA.pdf. Acesso em: 24 ago. 2023. 9. Takei K, Takahashi F, Liu S, Tsuda K, Palumbo J. Post-hoc analysis of randomized, placebo-controlled, double-blind study (MCI186-19) in amyotrophic lateral sclerosis. Amyotroph Lateral Scler Frontotemporal Degener. 2017;18(sup 1):49-54. 10. Shefner J, Heiman-Patterson T, Pioro EP, Wiedau-Pazos M, Liu S, Zhang J, et al. Long-term edaravone efficacy in amyotrophic lateral sclerosis: posthoc analyses of Study 19 (MCI186-19). Muscle Nerve. 2020;61(2):218-221. 11. Kalin A, Medina-Paraiso E, Ishizaki K, Kim A, Zhang Y, Saita T, et al. A safety analysis of edaravone (MCI-186) during the first six cycles (24 weeks) of amyotrophic lateral sclerosis (ALS) therapy from the double-blind period in three randomized, placebo-controlled studies. Amyotroph Lateral Scler Frontotemporal Degener. 2017;18(sup1):71-79. 12. Carri, Maria Teresa et al. "Oxidative stress and mitochondrial damage: importance in non-SOD1 ALS." Frontiers in cellular neuroscience vol. 9 41. 17 Feb. 2015, doi:10.3389/fncel.2015.00041 13. Van Damme, Philip et al. "Modelling amyotrophic lateral sclerosis: progress and possibilities." Disease models & mechanisms vol. 10,5 (2017): 537-549. doi:10.1242/dmm.029058 14. Kiernan, Matthew C et al. "Amyotrophic lateral sclerosis." Lancet (London, England) vol. 377,9769 (2011): 942-55. 15. Tzeplaeff, Laura et al. "Current State and Future Directions in the Therapy of ALS." Cells vol. 12,11 1523. 31 May. 2023, 16. Writing Group; Edaravone (MCI186) ALS 19 Study Group. Open-label 24-week extension study of edaravone (MCI186) in amyotrophic lateral sclerosis. Amyotroph Lateral Scler Frontotemporal Degener. 2017;18(sup1):55-63. 17. Takei K, Tsuda K, Takahashi F, Palumbo J. Post-hoc analysis of open-label extension period of study MCI186-19 in amyotrophic lateral sclerosis. Amyotroph Lateral Scler Frontotemporal Degener. 2017;18(sup1):64-70. 18. CMED. Lista de preço dos medicamentos. Disponível em: https://www.gov.br/anvisa/pt-br/assuntos/medicamentos/cmed/precos. Acesso em 21/10/2024.
RADICAVA® (edaravona). INDICAÇÕES: inibição da progressão do distúrbio funcional em pacientes com esclerose lateral amiotrófica (ELA). CONTRAINDICAÇÕES: hipersensibilidade aos componentes da formulação. CUIDADOS E ADVERTÊNCIAS: Os pacientes devem ser monitorados cuidadosamente pois pode ocorrer reação anafilática. O medicamento contém bissulfito de sódio, que pode causar reação do tipo alérgico. Gravidez: uso não recomendado. Lactação: a lactação durante o uso não deve ser permitida. INTERAÇÕES MEDICAMENTOSAS: o uso concomitante com antibióticos como cefazolina sódica, cloridrato de cefotiam e piperacilina sódica pode agravar o comprometimento renal. REAÇÕES ADVERSAS: erupção cutânea, eczema, glicosúria, contusão, distúrbios da marcha, cefaleia, distúrbios respiratórios, infecção por Tinea. POSOLOGIA: 60 mg de edaravona, administrados por infusão intravenosa durante 60 minutos. Ciclo inicial: administração diária por 14 dias, seguido de período de 14 dias sem administração. Ciclos subsequentes: administração diária por 10 dias em período de 14 dias, seguido de período de 14 dias sem administração. VENDA SOB PRESCRIÇÃO MÉDICA. Reg MS.: 1.0454.0192. Registrado por: Daiichi Sankyo Brasil Farmacêutica Ltda. Serviço de Atendimento ao Consumidor: 0800-055-6596.
SE PERSISTIREM OS SINTOMAS, O MÉDICO DEVERÁ SER CONSULTADO. MB_01