


ENHERTU® (trastuzumabe deruxtecana, T-DXd), medicamento já conhecido para o tratamento de câncer de mama**, acaba de ganhar uma nova indicação: tratamento de câncer gástrico localmente avançado ou metastático.1-3
A nova indicação inclui pacientes adultos com adenocarcinoma gástrico ou da junção gastroesofágica (JGE) localmente avançado ou metastático HER2 positivo que receberam um regime prévio baseado em trastuzumabe.3
Solicite estudos e materiais sobre T-DXd
DESTINY-Gastric01: incluiu pacientes com câncer gástrico ou JGE localmente avançado ou metastático HER2 positivo que receberam pelo menos duas terapias prévias (incluindo trastuzumabe). DESTINY-Gastric02: incluiu pacientes com câncer gástrico ou JGE localmente avançado ou metastático HER2 positivo que receberam pelo menos uma terapia anterior (1ª linha) contendo regime com trastuzumabe.
Adaptado de: Shitara K, et al. N Engl J Med. 2020 Jun 18;382(25):2419-2430. Van Cutsem E, et al. T. Lancet Oncol. 2023 Jul;24(7):744-756.
A Diretriz do NCCN (National Comprehensive Cancer Network) inclui o ENHERTU® (trastuzumabe deruxtecana, T-DXd) como o único tratamento anti-HER2+ preferencial para 2L+ no câncer gástrico HER2 positivo (Categoria 2A).4, 5
Assista a contribuição da médica oncologista britânica, Dra. Elizabeh (Lizzy) Smyth.

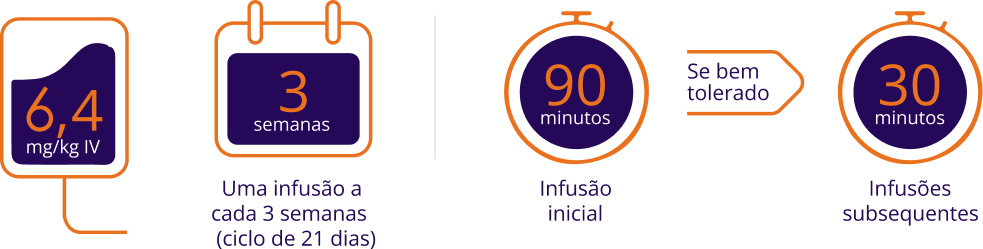
Adaptado de: Bula de Enhertu®.4
Confira os materiais para consulta sobre o manejo adequado de pacientes em tratamento com ENHERTU®.
* Dados de eficácia de Enhertu® em pacientes previamente tratados com trastuzumabe. ** Vide indicação descrita ao fim deste material.
Referências: 1. Shitara K, et al.; DESTINY-Gastric01 Investigators. Trastuzumab Deruxtecan in Previously Treated HER2-Positive Gastric Cancer. N Engl J Med. 2020 Jun 18;382(25):2419-2430. 2. Van Cutsem E, et al. Trastuzumab deruxtecan in patients in the USA and Europe with HER2-positive advanced gastric or gastroesophageal junction cancer with disease progression on or after a trastuzumab-containing regimen (DESTINY-Gastric02): primary and updated analyses from a single-arm, phase 2 study. Lancet Oncol. 2023 Jul;24(7):744-756. 3. Bula de Enhertu®. 4. National Comprehensive Cancer Network (NCCN) guidelines. Gastric Cancer. Versão 1.2023. Disponível em: https://www.nccn.org/professionals/physician_gls/pdf/gastric.pdf. Acesso em: 08/08/23 às 10h. 5. National Comprehensive Cancer Network (NCCN) guidelines. Esophageal and Esophagogastric Junction Cancers. Versão2.2023. Disponível em: https://www.nccn.org/professionals/physician_gls/pdf/esophageal.pdf. Acesso em: 08/08/23 às 10h.
ENHERTU® (trastuzumabe deruxtecana). INDICAÇÕES: Câncer de mama: tratamento de pacientes adultos com câncer de mama HER2-positivo metastático ou não ressecável, que tenham recebido um regime de tratamento baseado em anti-HER2 no cenário metastático, ou no cenário neoadjuvante ou adjuvante, e que desenvolveram recorrência da doença durante ou dentro de 6 meses após a conclusão do tratamento. Tratamento de pacientes adultos com câncer de mama HER2 de baixa expressão (IHC 1+ ou IHC 2+/ISH-) metastático ou não ressecável que tenham recebido uma terapia sistêmica prévia no cenário metastático, ou que desenvolveram recorrência da doença durante ou dentro de 6 meses após a conclusão de quimioterapia adjuvante. Pacientes com câncer de mama HER2 de baixa expressão com receptor hormonal positivo (RH+) devem também ter recebido ou ser inelegíveis a terapia endócrina. Câncer de pulmão: tratamento de pacientes adultos com câncer de pulmão de não pequenas células (CPNPC) não ressecável ou metastático cujos tumores tenham mutações HER2 (ERBB2) ativadoras e que tenham recebido uma terapia sistêmica prévia. Câncer gástrico: tratamento de pacientes adultos com adenocarcinoma gástrico ou da junção gastroesofágica (JGE) localmente avançado ou metastático HER2-positivo que receberam regime anterior à base de trastuzumabe. Outros tumores sólidos: tratamento de pacientes adultos com tumores sólidos HER2-positivos (IHC3+) irressecáveis ou metastáticos que receberam tratamento prévio ou que não possuem opções de tratamento alternativas satisfatórias. CONTRAINDICAÇÕES: hipersensibilidade ao trastuzumabe deruxtecana ou a qualquer dos componentes da formulação. CUIDADOS E ADVERTÊNCIAS: casos de doença pulmonar intersticial (DPI) e/ou pneumonite foram relatados com ENHERTU®. Os pacientes devem ser orientados a relatar imediatamente no caso de tosse, dispneia, febre e/ou qualquer novo sintoma ou piora de sintomas respiratórios, e devem ser monitorados para sinais ou sintomas de DPI / pneumonite. Casos de neutropenia, incluindo neutropenia febril foram relatados nos estudos clínicos de ENHERTU®. O hemograma completo deve ser monitorado antes do início do tratamento com ENHERTU® e antes de cada dose, conforme clinicamente indicado. Redução da fração de ejeção de ventrículo esquerdo (FEVE) é observada com terapias anti-HER2. A FEVE deve ser avaliada antes do início do tratamento com ENHERTU® e em intervalos regulares durante o tratamento, conforme clinicamente indicado. Categoria de risco na gravidez: D. A administração de ENHERTU® a gestantes não é recomendada e as pacientes devem ser informadas dos potenciais riscos ao feto antes de engravidarem. Mulheres que engravidarem devem imediatamente contatar seu médico. Caso uma mulher engravide durante o tratamento com ENHERTU®, ou em até sete meses após a última dose do tratamento, é recomendado monitoramento próximo. Lactação: não se sabe se ENHERTU® é excretado no leite materno humano. Como muitos fármacos são excretados no leite humano, e devido ao potencial de reações adversas graves em lactentes em aleitamento materno, as mulheres devem descontinuar a amamentação antes do início do tratamento com ENHERTU®. As mulheres podem iniciar o aleitamento sete meses após a última dose do tratamento. INTERAÇÕES MEDICAMENTOSAS: a coadministração com ritonavir aumentou a exposição do trastuzumabe deruxtecana em 19% e do inibidor da topoisomerase I livre em 22%. Não é necessário ajuste de dose durante a administração concomitante de ENHERTU® com medicamentos inibidores da OATP1B ou CYP3A. Não é esperada interação clinicamente significativa com medicamentos inibidores da P-gp, MATE2-K. MRP1 ou transportadores BCRP. REAÇÕES ADVERSAS: náusea, fadiga, vômito, alopecia, constipação, redução do apetite, anemia, neutropenia, diarreia, dor abdominal, estomatite, dispepsia, trombocitopenia, tosse, leucopenia, neutropenia, linfopenia, pirexia, transaminase aumentadas, fosfatase alcalina aumentada, infecção do trato respiratório superior, hipocalemia, dor muscoloesquelética, dor de cabeça, doença pulmonar intersticial, dispneia, epistaxe, erupção cutânea, redução de peso, tontura, edema periférico, pneumonia, diminuição de sódio. POSOLOGIA: ENHERTU® deve ser administrado em infusão intravenosa a cada 3 semanas (ciclo de 21 dias), até progressão da doença ou toxicidade não manejável. Câncer de mama, câncer de pulmão, outros tumores sólidos: a dose recomendada é 5,4 mg/kg. Câncer gástrico: a dose recomendada é 6,4 mg/kg. Pode ser necessária a interrupção temporária, redução de dose ou descontinuação do tratamento com ENHERTU® em decorrência de reações adversas. USO RESTRITO A ESTABELECIMENTOS DE SAÚDE. VENDA SOB PRESCRIÇÃO MÉDICA. Registro: 1.0454.0191. Registrado por: Daiichi Sankyo Brasil Farmacêutica Ltda. Serviço de Atendimento ao Consumidor: 0800-055-6596. Informações adicionais à disposição da classe médica. SE PERSISTIREM OS SINTOMAS, O MÉDICO DEVERÁ SER CONSULTADO. MB_07
